
시판된 의약품이 5년마다 의약품 품목허가 갱신 시 안전 관련 자료 제출요건 등 안전성 검토가 강화된다.
18일 식품의약품안전처는 '의약품의 품목 갱신에 관한 규정' 개정 고시안을 5월 15일 행정예고한다고 밝혔다.
2013년에 도입된 '의약품 품목허가 갱신' 제도는 허가 신고한 모든 의약품에 대해 5년마다 갱신 여부를 판단함으로써 의약품을 체계적이고 실효성있게 관리하기 위해 만들어졌다. 의약품 품목갱신 대상은 모든 의약품이 해당되며 갱신 후 5년의 유효기간을 부여받게 되며, 원료의약품은 갱신 대상에서 제외된다.
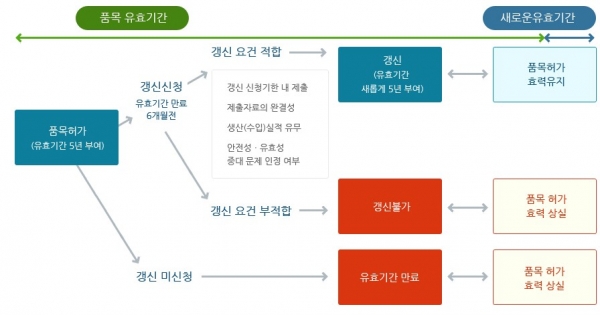
식약처는 이번 개정은 업체의 의약품 시판 후 안전관리 수준을 높이고 품목 갱신 시 실효성 있는 안전성 검토를 강화하기 위해 추진되었다고 밝혔다.
안전관리에 관한 자료를 기존에는 부작용 신속 ·정기보고 여부만 제출하면 되었는데 개정되면 안전관리책임자가 수집자료를 분석 평가한 결과와 안전조치 자료 일체를 추가로 제출해야 한다.
국내 시판용으로 허가받은 의약품을 수출용으로 전환한 이후 다시 국내용으로 되돌릴 경우 종전에 부여받은 유효기간에서 수출용 기간을 제외한 잔여기간만 인정하도록 하였다.
식약처는 품목 갱신제도가 우리 국민에게 안전과 품질이 확보된 의약품만 공급하게 하는 안전장치로서 기능할 수 있도록 지속적인 보완을 해나갈 것이라고 밝혔다.
포인트경제 김수철 기자
관련기사
김수철 기자
kimsc@pointe.co.kr

