FDA 긴급사용승인으로 수출 급물살 기대
2019년 기술성 평가에서 AA등급
코스닥 상장예비심사 무난히 통과 성공

지난 24일 코로나19 진단키트에 관한 미국 식품의약국(FDA) 긴급사용승인을 획득해 주목받은 젠큐릭스가 오늘 25일 코스닥에 상장했다.
분자진단 전문 바이오 기업 젠큐릭스는 기술특례 상장 기준이 더 엄격해진 상황에 2019년 기술성 평가에서 AA등급을 받았고 2020년 코스닥 상장예비심사를 무난히 통과해 코스닥 입성에 성공했다고 밝혔다.
젠큐릭스는 독자적인 분자진단 기술을 바탕으로 다양한 진단 키트를 개발하고 생산하는 분자진단전문 바이오업체이다. PCR 기술을 바탕으로 타깃 유전자를 특이적으로 검출하는 기술로 더 정확한 검사 결과를 제공하고 있다.
이번에 젠큐릭스는 코로나19 진단키트(GenePro SARS-CoV-2 Test)의 긴급사용승인을 획득과 상장으로 수출에도 급물살을 탈 것으로 기대되고 있다.
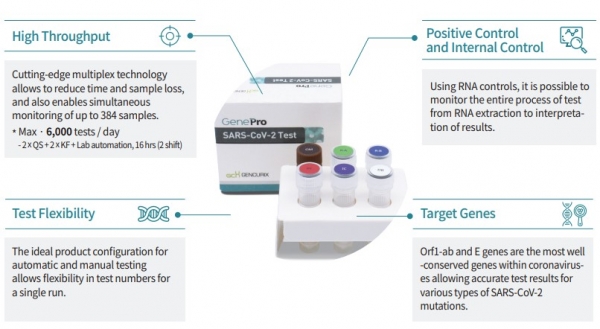
회사 관계자는 젠큐릭스의 코로나19 진단키트로 대량 검사가 가능하고 코로나19 확산세가 심각한 미국 및 중남미를 중심으로 수출이 본격화될 것으로 예상한다고 설명했다.
'GenePro SARS-CoV-2 Test'는 지난 3월에 젠큐릭스가 발표한 'GenePro COVID-19 Detection Test' 첫 번째 테스트 분석에 이어 두 번째 RT-PCR 테스트이다.
기존 진단 키트는 대부분 한 번에 96개까지 샘플을 검사할 수 있지만, 젠큐릭스의 진단 키트는 4배인 384개의 샘플을 한 번에 검사할 수 있다.
현재 일일 확진자 수가 2백만명이 넘는 미국과 전국민의 4분의 1을 검사하는 방안을 추진 중인 브라질 등 중남미에서 수요가 많을 것으로 보고 있다.
젠큐릭스는 이미 미국 UCLA를 비롯해 캘리포니아, 뉴욕, 뉴저지, 플로리다, 유타 등 미국 내 진단 센터들에서 코로나19 진단키트의 성능 테스트를 진행하고 제품 성능을 확인했다고 밝혔다.
또한 올해 3월부터 코로나19 진단키트 생산 공정을 지속적으로 개선해 대량 주문에도 무리없이 대응할 수 있다고 밝혔다.
한편 젠큐릭스는 올해 주요 사업 중 하나인 유방암 예후진단 검사의 혁신의료기술 지정을 예상하고 있으며 폐암 동반진단 검사의 건강보험 등재도 앞두고 있는 것으로 전해졌다.
포인트경제 유민정 기자

