밀착도 강화 등 바이러스, 박테리아, 혈액·체액 등 차단 목적
허가·심사 가이드라인 발간 등 안전관리체계 마련
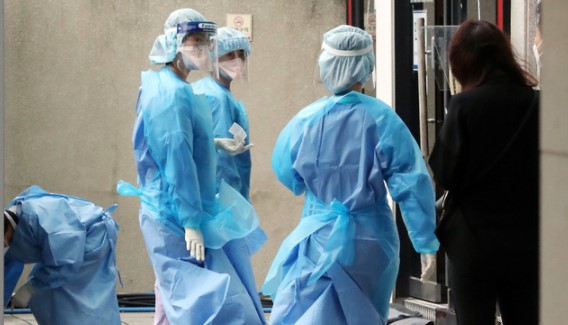
코로나19 등 특정 질병이나 감염 예방을 위해 사용하는 국내용 '의료용 호흡기 보호구' 품목이 신설된다. 식품의약품안전처는 허가·심사 가이드라인 발간 등 안전관리체계를 마련한다.
28일 식품의약품안전처는 의료인을 위한 '의료용 호흡기 보호구' 품목을 신설하는 '의료기기 품목 및 품목별 등급에 관한 규정' 개정안을 행정예고했다.
신설되는 한국형 '의료용 호흡기 보호구'는 의료진의 안전을 위해 생물학적 감염 방지 등 반드시 필요한 성능을 확보해 의료현장에서 사용될 수 있도록 필수 시험항목을 정해 허가 관리한다.
의료용 호흡기 보호구 성능시험항목은 △여과효율 △호흡저항 △인공혈액 침투저항성 △난연성 △생체적합성 △밀착도 △누설률 △미생물한도 △머리끈의 인장강도 등이다.
식약처는 밀착도를 강화하는 등 바이러스, 박테리아, 혈액·체액 등을 차단하는 목적으로 사용하도록 했다.
신설품목은 현재 의료기관에서 주로 사용하는 미국의 의료용 N95 호흡기 보호구(Surgical N95 Respirator)를 국산화한 것으로 앞으로 국내 방역현장 등에서 의료인이 사용하게 된다.
식약처는 신속한 도입을 위해 이번달 초 의료기기위원회에서 해당 품목신설의 심의 결정하고 9월 중 관련 고시를 개정할 예정이라고 밝혔다.
또한 신설품목의 허가를 신청하는 업체에 실질적인 도움이 되도록 ‘의료용 호흡기 보호구 허가·심사 가이드라인’을 함께 발간하여 ▲필수시험 항목 ▲제출 자료 ▲허가·심사 시 주요 고려사항 ▲허가신청서 기재사항 예시 등을 안내했다.
이번 품목신설로 의료기기 분야에 새롭게 진입하는 국내 업체에는 맞춤형 허가도우미* 제도를 통해 신속히 허가받을 수 있도록 지원한다고 밝혔다.
포인트경제 김지연 기자

